Теория эволюции
В поисках начала эволюции
В настоящее время ведется активный поиск стартовой точки биологической эволюции — первого репликатора, с появлением которого задача объяснения дальнейшего развития эволюционирующих систем принципиально упрощается. Как же без помощи естественного отбора мог появиться первый репликатор?
 |
В настоящее время «творческие способности» дарвиновской эволюции хорошо известны биологам. Однако до сих пор ведется активный поиск ее стартовой точки, точнее, первого репликатора (от лат. replicatio — возобновление, повторение), с появлением которого задача объяснения дальнейшего развития эволюционирующих систем принципиально упрощается. Как же без помощи естественного отбора мог появиться первый репликатор?
Репликаторы — это объекты, которые не только способны «размножаться» (производить собственные копии тем или иным способом, например путем химического катализа), но и должны обладать наследственной изменчивостью. Иными словами, копирование некоего объекта должно быть не абсолютным, но все же достаточно точным, чтобы в череде поколений устойчиво воспроизводились его свойства (причем не только «общеродовые», но и индивидуальные) и при этом какие-то из наследственных различий влияли бы на эффективность размножения.
Еще в 1968 г. американский микробиолог К. Везе впервые предположил, что жизнь могла возникнуть на основе самореплицирующейся РНК, а спустя два десятилетия его знаменитый соотечественник У. Гилберт, получивший в 1980 г. Нобелевскую премию по химии за метод секвенирования ДНК, обосновал гипотезу «мира РНК». К настоящему времени эта гипотеза стала наиболее экспериментально обоснованной моделью происхождения жизни из неживой материи (абиогенеза).
Одинокий рибозим
Во многих версиях теории РНК-мира предполагается, что первым репликатором был рибозим с РНК-полимеразной активностью, способный катализировать матричный синтез (репликацию) других молекул РНК, в том числе — собственных копий, примерно так, как это делают современные белковые ферменты-полимеразы.
Репликация РНК на заре жизни могла катализироваться не напрямую рибозимами, а некими «посредниками», например короткими пептидами (синтез которых, в свою очередь, мог катализироваться рибозимами), или РНК-пептидными комплексами. Возможно, эту функцию выполняли простейшие пептиды, состоящие из аминокислот, которые встречаются в космосе и легко получаются в экспериментах по абиогенному синтезу органики: глицина, аланина, валина, аспарагиновой кислоты, серина. О возможном строении таких «пребиотических» пептидов можно судить по устройству активных центров некоторых современных РНК-полимераз, где три отрицательно заряженных остатка аспарагиновой кислоты удерживают ион магния, играющий ключевую роль в катализе репликации РНК [1]Gulik P. van der, Massar S., Gilis D. et al. The first peptides: the evolutionary transition between prebiotic amino acids and early proteins // J. Theor. Biol. 2009. V.261. P.531–539.
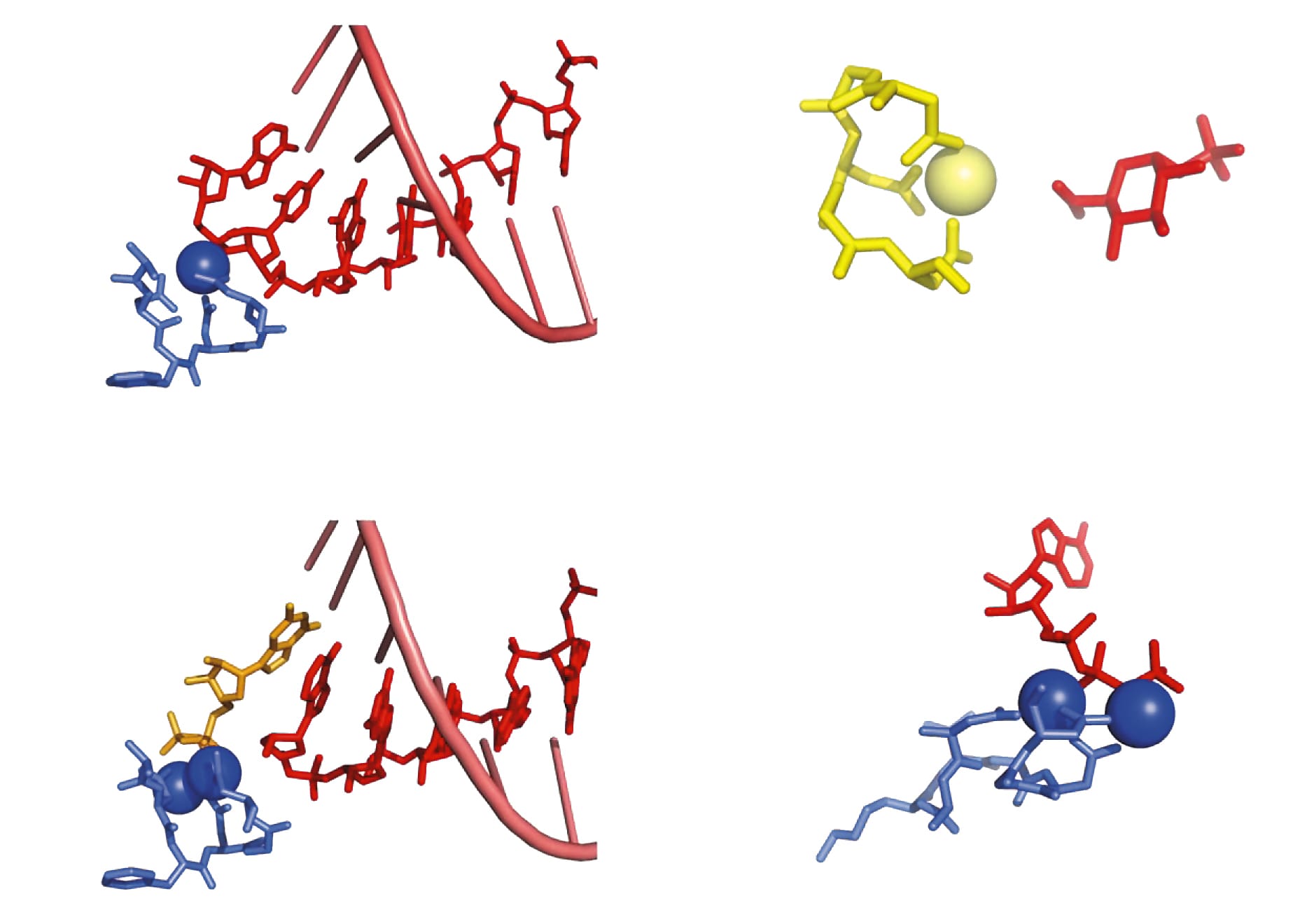
Однако предположение о существовании молекул РНК, умеющих самовоспроизводиться без посредников, кажется более простым и потому заманчивым.
У современных организмов таких рибозимов нет. Это неудивительно: их давно должны были вытеснить более эффективные белковые полимеразы. Поэтому ученые пытаются получить их искусственно, сочетая методы «искусственной эволюции» и целенаправленного проектирования. В первом случае синтезируют много РНК со случайными последовательностями, отбирают из них обладающие нужным свойством хотя бы в минимальной степени, вносят случайные мутации, снова отбирают и т. д. При целенаправленном проектировании секвенируют получившийся на каком-то этапе «искусственной эволюции» рибозим, анализируют его структуру. Затем необходимо решить, как его можно усовершенствовать (что лишнее отрезать, что добавить), исходя из знаний о связи свойств молекулы РНК с ее структурой.
Doi:10.1038/nature13935
В необъятном пространстве последовательностей всех возможных молекул РНК уже найдены рибозимы, способные катализировать матричный синтез РНК — правда, с низкой эффективностью. В роли матрицы в экспериментах выступает одиночная нить РНК, на которой из активированных нуклеотидов последовательно синтезируется комплементарная нить. Лучшие из полученных рибозимов-полимераз способны реплицировать матрицы длиной до 206 нуклеотидов, что превышает длину самого рибозима [2]Attwater J., Wochner A., Holliger P. In-ice evolution of RNA polymerase ribozyme activity // Nat. Chem. 2013. V.5. P.1011–1018.Doi:10.1038/nchem.1781 Удалось продемонстрировать синтез функционального рибозима (с иной каталитической активностью и меньшего размера) с помощью рибозима-полимеразы [3]Wochner A., Attwater J., Coulson A. et al. Ribozyme-Catalyzed Transcription of an Active Ribozyme // Science. 2011. V.332. P.209–212.Doi:10.1126/science.1200752
Судя по результатам подобных опытов, рибозим-полимераза должен быть довольно большим (100 – 200 нуклеотидов). Спонтанное возникновение такой молекулы без дарвиновского механизма маловероятно. Е. В. Кунин в своей выдающейся книге «Логика случая» попытался рассчитать, мог ли случайно собраться такой рибозим хотя бы на одной планете (если предположить, что на всех планетах земного типа шел спонтанный синтез РНК со случайными последовательностями), и ему лишь с большими натяжками хватило для этого размеров наблюдаемой Вселенной [4]Кунин Е.В. Логика случая. О природе и происхождении биологической эволюции. М., 2014.
Рибозим-полимераза, без посторонней помощи реплицирующий свои копии, должен быть еще и довольно точным, чтобы избежать необратимой мутационной деградации: он должен делать не более одной-двух ошибок за акт репликации. Если его длина 100 – 200 нуклеотидов, это соответствует частоте мутаций около 0.01.
Те рибозимы-полимеразы, которые уже удалось получить, близки к этому минимально допустимому уровню точности. Однако они не могут реплицировать сами себя. Их главный недостаток — сильная зависимость эффективности репликации от последовательности нуклеотидов в матрице. В отличие от белковых полимераз, рибозимам-полимеразам не все равно, какие нуклеотиды и в каком порядке стоят в копируемой матрице. Поэтому далеко не всякая матрица может быть реплицирована данным рибозимом.
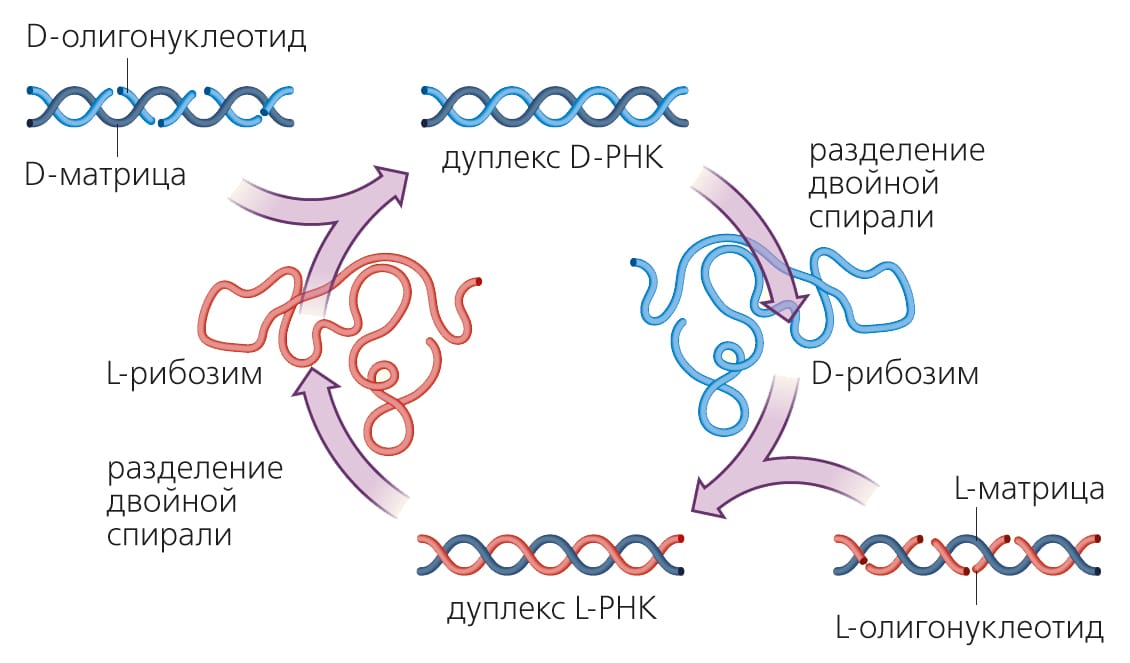
Рибозимы-полимеразы наверняка будут в дальнейшем усовершенствованы. Например, недавно выяснилось, что их искусственную эволюцию удобно вести во льду; это позволило сильно улучшить прежние показатели [2]Attwater J., Wochner A., Holliger P. In-ice evolution of RNA polymerase ribozyme activity // Nat. Chem. 2013. V.5. P.1011–1018.Doi:10.1038/nchem.1781 Еще одно недавнее достижение — получение короткого (всего 83 нуклеотида!) рибозима — кросс-хиральной РНК-полимеразы [5]Sczepanski J.T., Joyce G.F. A cross-chiral RNA polymerase ribozyme // Nature. 2014. V.515. P.440–442.Doi:10.1038/nature13900 Этот рибозим, состоящий из «правых» нуклеотидов (из них состоят все молекулы РНК в клетках; правые нуклеотиды содержат правый энантиомер рибозы), способен катализировать репликацию собственной зеркальной копии — такого же рибозима, только сделанного из левых нуклеотидов. Левый рибозим, в свою очередь, может катализировать репликацию исходного правого рибозима. Замечательно, что кросс-хиральные РНК-полимеразы оказались более универсальными, чем их «коллеги», работающие с субстратами той же хиральности: их эффективность почти не зависит от последовательности нуклеотидов в матрице. Причина в том, что молекулы РНК разной хиральности не образуют друг с другом уотсон-криковских связей, основанных на принципе комплементарности. Поэтому кросс-хиральным полимеразам приходится узнавать свой субстрат и взаимодействовать с ним благодаря своей третичной, а не первичной структуре, что и приводит к ослаблению зависимости их эффективности от последовательности нуклеотидов в матрице.
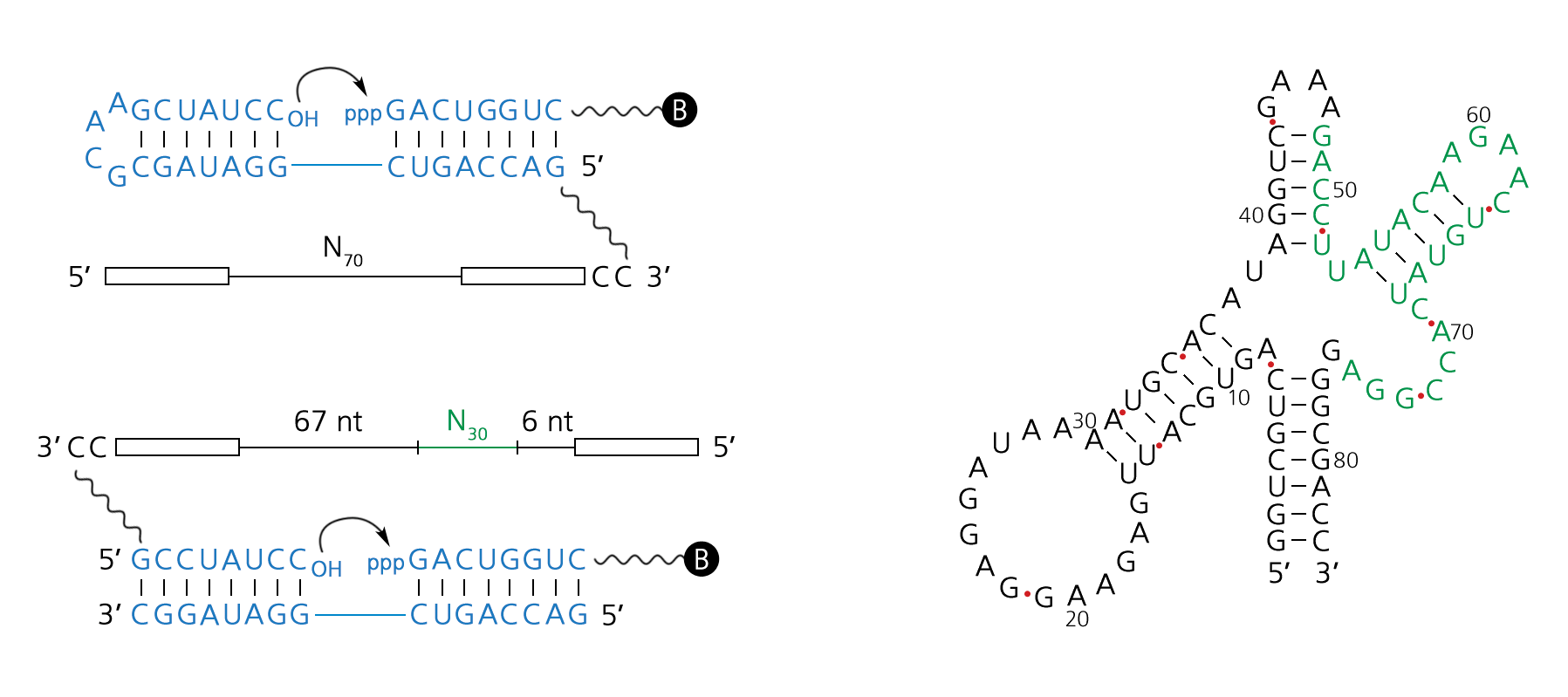
Безусловно, главная трудность, связанная с идеей о рибозиме-полимеразе в роли первого репликатора, состоит в том, что его спонтанное появление слишком маловероятно. Гипотеза о том, что большая функциональная молекула получилась «просто так», без эволюции, без отбора, без использования матричного синтеза и комплементарности, в результате случайного комбинирования нуклеотидов, выглядит слишком неэкономной, «притянутой за уши». Можно, конечно, следуя за Куниным, привлечь слабый антропный принцип и теорию множественных вселенных. Если наша Вселенная — лишь одна из бесчисленного множества существующих, то «число попыток» абиогенеза было столь большим, что мы вправе допустить — в зарождении жизни на нашей планете повинна цепочка крайне маловероятных, почти чудесных совпадений. Но все-таки хотелось бы обойтись без этого крайнего средства (например, чтобы не потерять надежду когда-нибудь встретить внеземную жизнь: если вероятность абиогенеза близка к нулю, нет никаких шансов найти в обозримом космосе еще одну живую планету).
Вопрос сводится к тому, можно ли прийти к рибозиму-полимеразе путем закономерного эволюционного развития (а не случайного комбинирования нуклеотидов). Могла ли эволюция стартовать до появления рибозима-полимеразы? В этом случае молекулы РНК с полимеразной активностью могли бы оказаться результатом, а не предпосылкой эволюции, что повышает вероятность абиогенеза в астрономическое число раз.
Репликаторы из рибозимов-лигаз
Тридцатилетний опыт изучения рибозимов ясно показал, что лигирование (сшивание коротких РНК в более длинные) дается рибозимам куда лучше, чем репликация путем последовательного присоединения отдельных нуклеотидов. В опытах по искусственной эволюции рибозимы-лигазы получаются легко и в большом разнообразии из случайных (причем довольно коротких) последовательностей нуклеотидов.
На этом основании разрабатываются модели, в которых путь к эффективному рибозиму-полимеразе идет через два следующих промежуточных этапа [6]Briones C., Stich M., Manrubia S.C. The dawn of the RNA World: Toward functional complexity through ligation of random RNA oligomers // RNA. 2009. V.15. P.743–749.Doi:10.1261/rna.1488609
Случайная полимеризация коротких РНК на минеральных матрицах. Особенно хорошо показал себя в этом отношении глинистый минерал монтмориллонит, на котором из нуклеотидов, активированных имидазолом или 1-метиладенином, удается синтезировать одноцепочечные РНК длиной до 50 нуклеотидов (если это полимеры одного нуклеотида) или до 20 нуклеотидов (из всех четырех нуклеотидов вперемежку) [7]Huang W., Ferris J.P. One-step, regioselective synthesis of up to 50-mers of RNA oligomers by montmorillonite catalysis //J. Am. Chem. Soc. 2006. V.128. P.8914–8919.
Формирование длинных РНК путем лигирования коротких. Этот процесс катализируют спонтанно возникающие (в ходе полимеризации на минералах) простые рибозимы-лигазы. Синтез длинных РНК и перекомбинирование их фрагментов (рекомбинация) в конце концов приводит к появлению рибозима-полимеразы.
Важным промежуточным этапом на этом пути могли стать примитивные репликаторы, представляющие собой содружества лигаз, собирающих копии друг друга из фрагментов (олигонуклеотидов).
Уже известны саморазмножающиеся рибозимы-лигазы, собирающие копии самих себя из двух половинок [8]Paul N., Joyce G.F. A self-replicating ligase ribozyme // PNAS. 2002. V.99. №20. P.12733–12740.Doi:10.1073/pnas.202471099 и более интересные комплексы молекул РНК, размножающие друг друга путем лигирования. Так, в 2009 г. американские ученые Т. Линкольн и Дж. Джойс из Научно-исследовательского института имени Эллен Скриппс подобрали несколько пар рибозимов, способных собирать копии друг друга из олигонуклеотидов [9]Lincoln T.A., Joyce G.F. Self-sustained replication of an RNA enzyme // Science. 2009. V.323. №5918. P.1229–1232.Doi:10.1126/science.1167856 В результате такого взаимного размножения популяция рибозимов может расти в геометрической прогрессии сколь угодно долго — для этого нужно только исправно снабжать ее «пищей», т.е. материалами для синтеза новых молекул РНК. За 30 ч популяция может в благоприятных условиях вырасти в 100 млн раз. Более того, заставив несколько разных пар размножающихся рибозимов конкурировать друг с другом за субстрат, исследователи вынудили их начать дарвиновскую эволюцию. В результате вывелись рекомбинантные рибозимы с повышенной скоростью размножения.
Единственное, что не позволяет назвать этот результат окончательным решением проблемы самовоспроизведения РНК, — это природа субстрата. Размножающиеся пары рибозимов-лигаз в описанных эспериментах используют для сборки молекул РНК не отдельные нуклеотиды, а довольно длинные фрагменты РНК — олигонуклеотиды. Причем не любые, а только строго определенные (поскольку взаимодействие между рибозимом и субстратом осуществляется путем формирования уотсон-криковских связей).
В дальнейшем было показано, что рибозимы-лигазы, способные к взаимной сборке, склонны формировать более сложные содружества — каталитические циклы, в которых одни молекулы собирают из кусочков другие [10]Vaidya N., Manapat M.L., Chen I. A. et al. Spontaneous network formation among cooperative RNA replicators // Nature. 2012. V.491. P.72–77.Doi:10.1038/nature11549 Удивительно, что такие сообщества рибозимов, основанные на взаимопомощи, размножаются быстрее «эгоистов» — молекул РНК, собирающих только копии самих себя.
Эти факты позволяют предположить, что на ранних этапах абиогенеза могли существовать примитивные репликаторы, представлявшие собой содружества рибозимов-лигаз и малоэффективных, неточных рибозимов-полимераз.
Полимеразы множили короткие олигонуклеотиды, а лигазы сшивали из них более крупные молекулы РНК — копии полимераз и самих себя. Любопытно, что некоторые рибозимы-лигазы одновременно обладают и слабой полимеразной активностью, т.е. могут использовать в качестве субстрата не только олиго-, но и мононуклеотиды (именно так обстоит дело с упомянутыми выше кросс-хиральными РНК-полимеразами).
Таким образом, момент появления первого полноценного репликатора (или, что то же самое, момент начала дарвиновской эволюции) мог наступить еще до формирования полноценных рибозимов-полимераз. Тем самым вероятность самозарождения первого репликатора повышается.
Участие лигаз, которые действительно спонтанно образуются в результате синтеза коротких случайных олигонуклеотидов (например, в ходе полимеризации на монтмориллонитовой матрице), облегчает путь к РНК-полимеразам и позволяет отодвинуть старт эволюции на более ранние этапы абиогенеза.
Но все же переход от первых лигаз к примитивному репликатору описанного выше типа вырисовывается пока довольно смутно, а главное, этот переход, по-видимому, должен был произойти без помощи дарвиновского эволюционного механизма. Отсюда следующий закономерный вопрос: не могла ли эволюция стартовать еще раньше?
Репликация без ферментов
Процесс, позволяющий (по крайней мере теоретически) отодвинуть начало эволюции максимально далеко в прошлое, известен. Это неферментативный матричный синтез, или неферментативная репликация РНК (либо какого-то другого полимера, который был предшественником РНК, — такая возможность тоже рассматривается специалистами, но в данной статье об этом речи нет). В присутствии ионов магния на однонитевой молекуле РНК могут спонтанно, без помощи белковых ферментов или рибозимов, полимеризоваться короткие комплементарные последовательности нуклеотидов. В результате образуются дуплексы.
Неферментативную репликацию (НР) РНК в 1980-х годах активно изучал известный британский химик Л. Оргел. Он добился немалых успехов; в частности, ему удалось реплицировать матрицу из 14 нуклеотидов, содержащих гуанин (G) и цитозин (C) [11]Acevedo O.L., Orgel L.E. Non-enzymatic transcription of an oligodeoxynucleotide 14 residues long // J. Mol. Biol. 1987. V.197. P.187–193.Doi:10.1016/0022-2836(87)90117-3 К концу жизни Оргел разочаровался в идее из-за многочисленных неразрешенных трудностей [12]Orgel L.E. Prebiotic chemistry and the origin of the RNA world // Crit. Rev. Biochem. Mol. Biol. 2004. V.39. №2. P.99–123.Doi:10.1080/10409230490460765 Однако в наши дни его дело продолжил американский биолог, лауреат Нобелевской премии 2008 г. Дж. Шостак. Особенность его подхода — уверенность в том, что жизнь зародилась внутри «протоклеток», окруженных липидными мембранами, а не в микрополостях минералов, как считают другие авторы [13]Adamala K., Szostak J.W. Nonenzymatic template-directed RNA synthesis inside model protocells // Science. 2013. V.342. P.1098–1100.Doi:10.1126/science.1241888
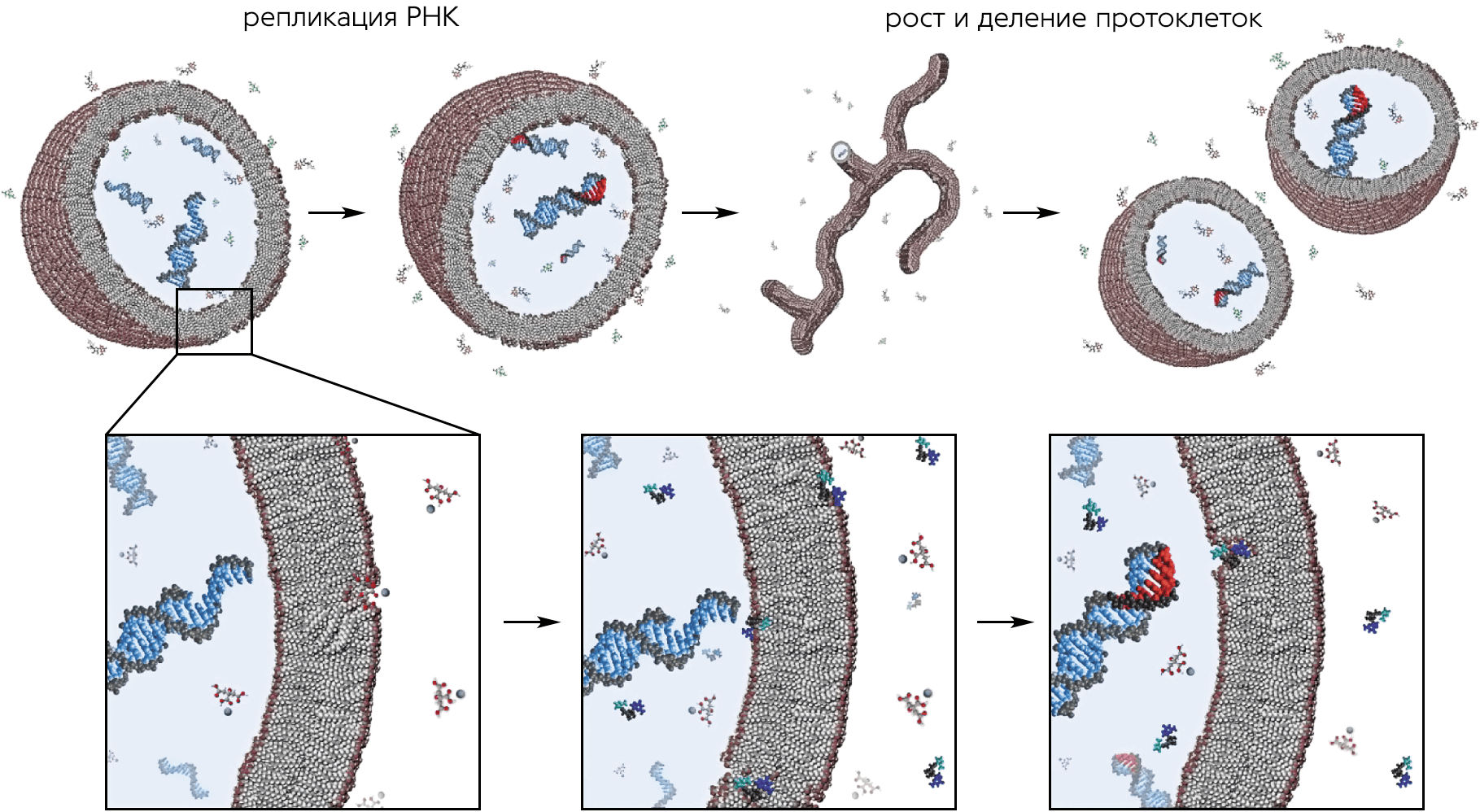
Жизненный цикл протоклетки.
Видео: www.exploringorigins.org
Современную ситуацию в области изучения неферментативной репликации РНК описал Шостак в обзорной статье, где выделил восемь препятствий, стоящих на пути эффективной НР, и наметил пути их преодоления [14]Szostak J.W. The eightfold path to non-enzymatic RNA replication // J. Sys. Chem. 2012. V.3. P.2–15.Doi:10.1186/1759-2208-3-2
Препятствие 1. Несовершенная региоспецифичность. В ходе неферментативной репликации наряду с «правильными» связями между нуклеотидами (3′ – 5′) образуются также «неправильные» (2′ – 5′). Впрочем, можно повысить долю правильных связей, если использовать в качестве катализатора ионы цинка, а не магния. Тот же эффект достигается, если активировать нуклеотиды не имидазолом, а 2-метил-имидазолом. Кроме того, такая ненаследуемая вариабельность связей, по-видимому, не препятствует эволюции функциональных рибозимов. В 2013 г. Шостак и его коллеги экспериментально показали, что рибозимы устойчивы к случайной ненаследуемой гетерогенности связей 2′ – 5′ и 3′ – 5′ [15]Engelhart A.E., Powner M.W., Szostak J.W. Functional RNAs exhibit tolerance for non-heritable 2’–5’ versus 3’–5’ backbone heterogeneity // Nature Chemistry. 2013. V.5. P.390–394.Doi:10.1038/nchem.1623
Препятствие 2. Высокая температура плавления РНК-дуплексов. Если в результате неферментативной репликации получается длинная двойная спираль, ее потом трудно (при условиях, совместимых с НР) разделить на две цепочки, чтобы цикл мог продолжиться. Поэтому предполагается, что условия в «колыбели жизни» чередовались [16]Ricardo A., Szostak J.W. Origin of life on Earth // Sci. Am. 2009. V.301. P. 54–61. временами там становилось очень горячо (например, из-за геотермальных выбросов), и двойные спирали расплетались; потом водоем остывал (локальный горячий выброс смешивался с окружающей водой), и неферментативная репликация могла продолжаться. Кроме того, на помощь приходит вышеупомянутая несовершенная региоспецифичность: даже небольшая примесь «неправильных» связей (2′ – 5′) сильно снижает температуру плавления РНК-дуплексов.
Шостак выдвинул еще одну красивую идею: несовершенная региоспецифичность могла на первых порах быть полезной еще и потому, что помогала рибозимам совмещать функцию катализа с функцией матрицы для НР. На каждой матрице синтезировались разные варианты реплик. Те из них, в которых было много неправильных связей, хуже сворачивались в трехмерные структуры, легче расплетались и потому лучше выполняли функцию матриц (но не рибозимов). В других репликах было мало неправильных связей, они сворачивались в прочные трехмерные структуры и хорошо работали рибозимами, хотя и с трудом реплицировались. Гомогенные продукты (только с «правильными» связями) не справились бы с обеими задачами сразу. Итак, возможно, что несовершенная региоспецифичность — никакая не проблема, а наоборот, ценнейшее свойство, которое позволило РНК стать «молекулой жизни».
Препятствие 3. Низкая точность копирования. Чтобы эффективно копировать хоть какие-то функциональные рибозимы до появления РНК-полимераз, неферментативная репликация должна иметь частоту ошибок не более 0.02. В действительности эта частота, как правило, выше (порядка 0.17). Ее можно снизить до 0.10 и даже 0.05, если брать матрицы с повышенным содержанием нуклеотидов G и C. Замечу, что большинство ошибок НР совершается при попытке присоединить нуклеотид уридин (U), поэтому чем меньше в матрице нуклеотидов аденозин (A), тем лучше. Не исключено, что повысить точность НР может замена U на 2-тио-U или даже 2-селено-U. Оба этих модифицированных нуклеотида иногда встречаются в антикодонах тРНК современных организмов, что повышает точность трансляции, поскольку эти нуклеотиды реже образуют «неправильную» пару с G, чем обычный U. Кто знает, может быть, это древний рудимент из эпохи пре-РНК-мира.
Еще один возможный путь преодоления данного препятствия основан на том, что после присоединения неправильного нуклеотида НР замедляется. Поэтому те акты репликации, которые проходят без ошибок, заканчиваются быстрее. Если нити быстро расплетаются и снова подвергаются НР, реальная точность НР может оказаться в 2 – 5 раз выше, чем думают экспериментаторы, когда измеряют эту точность единожды в конце опыта, после того как все матрицы один раз отреплицировались. Благодаря этому эффекту есть шанс не сорваться в пропасть мутационной деградации, даже имея базовую частоту ошибок 0.05 – 0.08 вместо требуемых 0.02.
Препятствие 4. Низкая скорость копирования. Неферментативная репликация идет примерно в том же временном масштабе, что и самопроизвольная деградация копируемой матрицы. Исследователи ищут условия, ускоряющие НР. Известно, что этот процесс идет быстрее во льду при –20°C, но это не устраивает Шостака, поскольку в таких условиях разрушаются мембранные пузырьки — протоклетки, с которыми он работает. Есть и другие обнадеживающие идеи; в частности, возможна неферментативная репликация путем присоединения очень коротких комплементарных олигонуклеотидов с последующим заполнением просветов и спонтанным лигированием кусочков в единую комплементарную нить [17]James K.D., Ellington A.D. Surprising fidelity of template-directed chemical ligation of oligonucleotides // Chem. Biol. 1997. V.4. №8. P.595–605.
Препятствие 5. Проблема реактивации. Активированные нуклеотиды гидролизуются, что снижает эффективность НР, а существующие способы реактивации нуклеотидов портят реплицируемую матрицу. По-видимому, простейший способ справиться с этой проблемой — перейти от замкнутой системы к проточной. РНК-матрицы или мембранные пузырьки, их содержащие, нужно закрепить (например, на поверхности минералов) и поместить в проточную систему с постоянным притоком свежих активированных нуклеотидов (правдоподобный механизм абиогенного синтеза активированных пиримидиновых нуклеотидов С и U был найден недавно британскими химиками [18]Powner M.W., Gerland B., Sutherland J.D. Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions // Nature. 2009. V.459. P.239–242.Doi:10.1038/nature08013
Препятствие 6. Двухвалентные ионы металлов, высокая концентрация которых необходима для НР, катализируют не только НР, но и деградацию одноцепочечных РНК. Кроме того, они разрушают мембраны протоклеток и повышают температуру плавления РНК-дуплексов.
Красивое решение этой проблемы было найдено Шостаком и его ученицей К. Адамалой в 2013 г. Они задумались о подборе хелатора, т.е. такой молекулы, которая, соединяясь с ионом магния, обхватывала бы его, как клешня, и лишала некоторых каталитических свойств, сохранив нужные. Адамала и Шостак испытали множество хелаторов и обнаружили, что некоторые из них (в том числе цитрат, изоцитрат, оксалат) защищают мембраны протоклеток от разрушения ионами магния. Но в большинстве случаев ионы магния при этом лишаются также и способности катализировать НР. Исключением оказался цитрат: в его присутствии репликация лишь немного замедлилась. Более того, цитрат полностью лишил ионы магния способности разрушать однонитевые молекулы РНК.
Установив эти факты, Адамала и Шостак экспериментально продемонстрировали возможность НР внутри протоклеток. Они изготовили мембранные пузырьки — протоклетки с молекулами РНК внутри. К каждой однонитевой матрице заранее прикреплялся праймер — фрагмент комплементарной последовательности, образующий с матрицей двойную спираль. При этом у матрицы оставался однонитевой хвостик, состоявший либо из нескольких нуклеотидов С (НР таких последовательностей идет быстрее всего), либо из чередующихся G и C. Затем в среду, где плавали протоклетки, добавили хлорид магния, цитрат и нуклеотиды, активированные имидазолом.
Опыт удался: через два-три дня большинство однонитевых участков оказались полностью реплицированы, т.е. молекулы стали целиком двуспиральными. В ходе работы подтвердилось предположение, что репликацию можно ускорить, если сделать систему проточной и своевременно удалять отходы (в том числе нуклеотиды, подвергшиеся незапланированному гидролизу). Еще один приятный сюрприз ждал исследователей, когда они проверили, не повлиял ли цитрат на температуру плавления двуспиральных РНК (которая, как говорилось, повышается в присутствии ионов магния). Оказалось, что температура плавления снизилась с 75° до 71° C.
Таким образом, простая мера — добавление хелатора — позволила преодолеть сразу несколько препятствий на пути к эффективной НР в протоклетках [13]Adamala K., Szostak J.W. Nonenzymatic template-directed RNA synthesis inside model protocells // Science. 2013. V.342. P.1098–1100.Doi:10.1126/science.1241888
Присутствовал ли абиогенно синтезированный цитрат в древних водоемах, служивших колыбелью зарождающейся жизни? До недавнего времени правдоподобные способы абиогенного синтеза цитрата не были известны. Ситуация изменилась в 2013 г., когда группа американских ученых нашла реалистичный путь абиогенного синтеза щавелево-уксусной кислоты (оксалоацетата) [19]Butch C., Cope E.D., Pollet P. et al. Production of tartrates by cyanide-mediated dimerization of glyoxylate: a potential abiotic pathway to the citric acid cycle // J. Am. Chem. Soc. 2013. V.135. P.13440–13445.Doi:10.1021/ja405103r От этого вещества до цитрата уже рукой подать.
Но Шостак и Адамала предлагают идею более интересную и глубокую, чем гипотеза о наличии абиогенного цитрата в «колыбели жизни». Роль хелатора, подавляющего негативные эффекты ионов Mg2+ и помогающего им катализировать НР, могли взять на себя короткие пептиды, включающие несколько остатков аспарагиновой кислоты (об этой возможности упомянуто в начале статьи). Наличие абиогенных аминокислот и простейших пептидов в «колыбели жизни» считается высоковероятным. С появления простых рибозимов, катализирующих соединение аминокислот друг с другом, скорее всего, началась эволюция белкового синтеза [20]Bokov K., Steinberg S.V. A hierarchical model for evolution of 23S ribosomal RNA // Nature. 2009. V.457. P.977–980.Doi:10.1038/nature07749 Шостак и его коллеги в настоящее время пытаются найти простые пептиды, способные помочь магнию катализировать НР лучше, чем это делает цитрат. По-видимому, это очень перспективный путь. «Содружество» пептидов с РНК, скорее всего, зародилось задолго до появления матричного белкового синтеза (трансляции).

Препятствие 7. Проблема праймеров. В экспериментах по изучению НР используются матрицы с заранее приделанными праймерами — комплементарными олигонуклеотидами, которые в ходе НР удлиняются на 3′-конце. Но откуда брались праймеры в «колыбели жизни»? Особенно остро эта проблема стоит для протоклеток, потому что пузырек, окруженный липидной мембраной, не может всасывать готовые праймеры извне — олигонуклеотиды не проходят через мембраны.
По мнению Шостака, должен существовать способ беспраймерной НР: моно- или олигонуклеотиды комплементарно пристраиваются прямо посередине матрицы, потом к ним присоединяются другие, кусочки лигируются, просветы заполняются. Эти возможности пока мало изучены.
Проблема праймеров в «мире НР» (в пре-РНК-мире) могла привести к тому, что селективное преимущество получали (т.е. быстрее размножались) те молекулы РНК, которым легче было найти себе праймер. Например, либо те, которые сами могли служить себе праймерами для самоудлинения («шпилька с хвостиком»), либо те, для которых в окружающей среде (протоклетке или минеральной микрополости) было много подходящих праймеров. Удобнейшим вариантом была бы способность молекулы РНК служить праймером для репликации собственных копий или реплик.
Препятствие 8. Обратное слипание комплементарных цепочек. Этот процесс идет гораздо быстрее, чем НР, и сильно затрудняет ее: получается двухцепочечная РНК, которая не может реплицироваться путем НР, пока цепочки не разъединятся. Простейший путь решения проблемы — уменьшить концентрацию РНК (матриц) в системе, ведь скорость «обратного слипания» пропорциональна квадрату их концентрации. Фактически проблема сводится к ограничению концентрации размножаемых молекул: если концентрация превышена, НР тормозится.
Даже в ходе полимеразной цепной реакции, где все делают белковые ферменты (с колоссальной скоростью), проблема обратного слипания не позволяет достигать слишком высоких концентраций размножаемой последовательности. А НР идет страшно медленно (присоединение одного нуклеотида в час — это хорошая скорость для НР), поэтому допустимые концентрации должны быть крайне низкими.
Противостоять обратному склеиванию может быстрое присоединение к разделившимся цепочкам коротких комплементарных олигонуклеотидов. Заодно это будет стимулировать дальнейшую НР, ведь такие прилипшие тут и там олигонуклеотиды — это промежуточные стадии НР, которые могут нарастать на 3′-концах, лигироваться и т. д. Для этого надо, чтобы коротких комплементарных олигонуклеотидов было достаточно много.
Шостак представляет себе «колыбель жизни» как геотермальный район с многочисленными прудами и озерами, сообщающимися, проточными и стоячими; в водоемы периодически поступали горячие выбросы, но большую часть времени там было относительно прохладно. В таких системах абиогенно синтезируемая органика могла достигать высоких концентраций. Первыми функциональными рибозимами, по мнению Шостака, были те, которые служили для «обмена веществ»: катализаторы синтеза фосфолипидов (что способствовало росту и делению протоклеток); реактивирующие рибозимы; нуклеазы, которые обрезали перекрывающиеся концы у олигонуклеотидов (это ускоряло НР), и т. д. Репликация РНК сначала была неферментативной. В конце концов лигазы и полимеразы стали ускорять репликацию, но нет оснований полагать, что лигазная и полимеразная функции появились первыми.
Так или иначе, нам больше не нужно предполагать, что полимеры, случайно образовавшиеся в большом количестве на древней Земле, лишь по чистой случайности обладали свойством комплементарности, т. е. были потенциально способны направлять процесс самокопирования. Разумеется, комплементарность должна была работать с самого начала. И с самого начала работал естественный отбор.
Палиндромный мир
На мой взгляд, главный вывод из сказанного состоит в следующем. Допустим, что где-то на ранней Земле или другом теле ранней Солнечной системы некогда существовали благоприятные условия для спонтанной полимеризации олигонуклеотидов на минеральных матрицах и для неферментативной репликации РНК. Тогда в этом мире дарвиновский (или квазидарвиновский) эволюционный процесс мог начаться не только до появления эффективных рибозимов-полимераз, но и до появления каких бы то ни было рибозимов.
«Проблема праймеров» могла привести к естественному отбору последовательностей, которые служили праймерами для самих себя, для своих копий или комплементарных реплик. В таком случае селективное преимущество могли получить последовательности, состоящие из коротких палиндромов (палиндром — это последовательность, левая и правая части которой комплементарны друг другу; палиндромные участки РНК имеют обыкновение сворачиваться в «шпильки»). Например, последовательность 5′-GGACCU.AGGUCC-3′ — это короткий палиндром. Точка посередине нарисована для удобства восприятия: она делит последовательность на два взаимно комплементарных блока. Реплика этой последовательности выглядит так: 3′-CCUGGA.UCCAGG-5′ (это, конечно, тоже палиндром, более того, реплика в данном случае идентична матрице). Такие простейшие палиндромы еще не дают желаемого эффекта. Но если немного удлинить последовательность, чтобы она состояла не из двух блоков, а из трех (или хотя бы из двух с половиной), то сразу открываются интересные возможности. Рассмотрим последовательность 5′-GGACCU.AGGUCC.GGAC-3′. Две такие последовательности могут, в соответствии с принципом комплементарности, соединиться разными способами.
Способ первый:
5′ GGACCU.AGGUCC.GGAC 3′
3′ CAGG.CCUGGA.UCCAGG 5′.
В этом случае НР не происходит, потому что у молекул нет «недостроенных» 3′-концов. Но исходные молекулы могут соединиться и по-другому:
5′ GGACCU.AGGUCC.GGAC→ 3′
3′ ←CAGG.CCUGGA.UCCAGG 5′.
Тогда обе молекулы могут послужить праймерами для НР. Их 3′-концы, присоединенные к матрицам (отмечены стрелками), будут достроены, и получим следующее:
5′ GGACCU.AGGUCC.GGACCU.AGGUCC 3′
3′ CCUGGA.UCCAGG.CCUGGA.UCCAGG 5′.
Затем эти две последовательности (они, между прочим, одинаковые: в мире палиндромных повторов матрица и реплика идентичны, когда число блоков четное) разъединятся в горячей фазе цикла, а потом смогут снова склеиться, опять-таки по-разному. Если по всей длине, то НР не пойдет и придется ждать следующей горячей фазы:
5′ GGACCU.AGGUCC.GGACCU.AGGUCC 3′
3′ CCUGGA.UCCAGG.CCUGGA.UCCAGG 5′.
Если внахлест со свободными 3′-концами, НР тоже не пойдет:
5′ GGACCU.AGGUCC.GGACCU.AGGUCC 3′
3′ CCUGGA.UCCAGG.CCUGGA.UCCAGG 5′.
Если внахлест со свободными 5′-концами, то обе молекулы смогут удлиниться:
5′ GGACCU.AGGUCC.GGACCU.AGGUCC → 3′
3′ ← CCUGGA.UCCAGG.CCUGGA.UCCAGG 5′.
Таким образом, в определенных условиях палиндромные последовательности будут размножаться быстрее других из-за способности к взаимному праймингу. В результате получатся растущие цепи палиндромных повторов с тенденцией к бесконечному росту. Добавим к этому происходящие время от времени случайные разрывы растущих цепей, причем любой обрывок с легкостью найдет для себя комплементарный участок на другой молекуле РНК, где он сможет выступить в роли праймера и снова удлиниться. Добавим еще формирование пространственных (третичных) структур. Очень скоро растущие молекулы начнут сворачиваться в разнообразные структуры с многочисленными шпильками. При этом каждая длинная молекула, состоящая из палиндромных повторов, может сложиться не одним, а многими разными способами (в зависимости от того, какие из палиндромных блоков спарятся друг с другом). В формировании трехмерных структур могут участвовать несколько молекул вместе, так что разнообразие структур (с потенциальными функциями) по мере удлинения нитей будет стремительно расти.
Периодически будут возникать одноцепочечные 5′-кончики, которые станут служить матрицами для удлинения 3′-концов. Везде, где 3′-конец ляжет на матрицу, продолжающуюся после него, пойдет неферментативная репликация, т.е. молекулы удлинятся. В одних микрополостях (или мембранных пузырьках) могут размножиться одни палиндромные повторы, в других — другие. Из-за неточности неферментативной репликации будут возникать мутации, что вызовет локальное несовершенство палиндромов. Если оно окажется сильным, НР может замедлиться (отсеется отбором), если слабым, может сохраниться и распространиться за счет дрейфа. В таком случае отбор может поддержать компенсирующие мутации, восстанавливающие совершенство палиндрома, и разнообразие последовательностей будет расти. Наращивание цепочек может происходить постепенно: за один цикл «горячо — холодно» здесь могут пристроиться два нуклеотида, там — четыре, тут — один, а в следующем цикле рост продолжится. Во многом это снимает проблему «медленности» НР.
Наследуемость возникающих трехмерных структур поначалу будет невысокой, поскольку каждый «генотип» (последовательность нуклеотидов) может порождать много разных «фенотипов» (способов сворачивания). На первых порах это облегчит адаптивную эволюцию, ведь неудачные вариации не будут жестко наследоваться. А случайно возникшие удачные способы сворачивания в дальнейшем смогут стабилизироваться путем закрепления мутаций, повышающих вероятность именно такого сворачивания (это напоминает известный эволюционный механизм «генокопирования модификаций»).
Достоинства модели «палиндромного мира», по-видимому, следующие:
- снимается проблема праймеров (она перестает быть проблемой и становится двигателем отбора в «мире НР»);
- обеспечивается рост и размножение последовательностей, которые легко образуют разнообразные трехмерные структуры («шпильки» — классический элемент всех рибозимов — основаны на палиндромах), что повышает вероятность появления функциональных рибозимов;
- формирование шпилек повышает устойчивость молекул РНК;
- даже самый ничтожный обрывок последовательности не пропадет, а послужит для дальнейшего роста цепочек: ведь он найдет себе комплементарную матрицу, к которой сможет присоединиться, чтобы подвергнуться удлинению при помощи НР.
Наконец, в один прекрасный момент в какой-то микрополости или протоклетке появится такой палиндром-мутант, который будет хоть чуть-чуть ускорять (катализировать) НР. Может быть, этот палиндром-мутант сможет взаимодействовать с абиогенным пептидом, содержащим несколько остатков аспарагиновой кислоты, которые удерживают ион магния или цинка. Содружество РНК с пептидами могло зародиться очень рано. С этого момента — с появления, пусть в самом зачаточном виде, РНК-полимеразной функции — начинается переход от «мира НР» к настоящему миру РНК.
Таким образом, есть основания предполагать очень раннее появление репликаторов, а значит, и ранний старт дарвиновской эволюции. После этого прохождение всех последующих этапов пути к первой живой клетке принципиально упрощается. Скорее всего, в истории земной жизни никогда не было того сомнительного этапа, на котором из случайных последовательностей нуклеотидов должна была сама собой, как Афродита из морской пены, родиться полнофункциональная РНК-полимераза. Более правдоподобной выглядит гипотеза, согласно которой естественный отбор начал направлять добиологическую эволюцию задолго до появления первых эффективных рибозимов.
Чтобы обосновать эту гипотезу, необходимо доказать, что условия для эффективной НР, во-первых, возможны, во-вторых, действительно когда-то существовали. Сделать это нелегко, но динамика научных открытий, совершаемых в последние годы, дает основания для осторожного оптимизма.
Работа выполнена при поддержке Российского научного фонда (проект № 14-14-00330).
Литература
- Gulik P. van der, Massar S., Gilis D. et al. The first peptides: the evolutionary transition between prebiotic amino acids and early proteins // J. Theor. Biol. 2009. V.261. P.531–539.
- Attwater J., Wochner A., Holliger P. In-ice evolution of RNA polymerase ribozyme activity // Nat. Chem. 2013. V.5. P.1011–1018.
- Doi:10.1038/nchem.1781.
- Wochner A., Attwater J., Coulson A. et al. Ribozyme-Catalyzed Transcription of an Active Ribozyme // Science. 2011. V.332. P.209–212.
- Doi:10.1126/science.1200752.
- Кунин Е.В. Логика случая. О природе и происхождении биологической эволюции. М., 2014.
- Sczepanski J.T., Joyce G.F. A cross-chiral RNA polymerase ribozyme // Nature. 2014. V.515. P.440–442.
- Doi:10.1038/nature13900.
- Briones C., Stich M., Manrubia S.C. The dawn of the RNA World: Toward functional complexity through ligation of random RNA oligomers // RNA. 2009. V.15. P.743–749.
- Doi: 10.1261/rna.1488609.
- Huang W., Ferris J.P. One-step, regioselective synthesis of up to 50-mers of RNA oligomers by montmorillonite catalysis //J. Am. Chem. Soc. 2006. V.128. P.8914–8919.
- Paul N., Joyce G.F. A self-replicating ligase ribozyme // PNAS. 2002. V.99. №20. P.12733–12740.
- Doi:10.1073/pnas.202471099.
- Lincoln T.A., Joyce G.F. Self-sustained replication of an RNA enzyme // Science. 2009. V.323. №5918. P.1229–1232.
- Doi:10.1126/science.1167856.
- Vaidya N., Manapat M.L., Chen I. A. et al. Spontaneous network formation among cooperative RNA replicators // Nature. 2012. V.491. P.72–77.
- Doi:10.1038/nature11549.
- Acevedo O.L., Orgel L.E. Non-enzymatic transcription of an oligodeoxynucleotide 14 residues long // J. Mol. Biol. 1987. V.197. P.187–193.
- Doi:10.1016/0022-2836(87)90117-3.
- Orgel L.E. Prebiotic chemistry and the origin of the RNA world // Crit. Rev. Biochem. Mol. Biol. 2004. V.39. №2. P.99–123.
- Doi:10.1080/10409230490460765.
- Adamala K., Szostak J.W. Nonenzymatic template-directed RNA synthesis inside model protocells // Science. 2013. V.342. P.1098–1100.
- Doi:10.1126/science.1241888.
- Szostak J.W. The eightfold path to non-enzymatic RNA replication // J. Sys. Chem. 2012. V.3. P.2–15.
- Doi:10.1186/1759-2208-3-2.
- Engelhart A.E., Powner M.W., Szostak J.W. Functional RNAs exhibit tolerance for non-heritable 2’–5’ versus 3’–5’ backbone heterogeneity // Nature Chemistry. 2013. V.5. P.390–394.
- Doi:10.1038/nchem.1623.
- Ricardo A., Szostak J.W. Origin of life on Earth // Sci. Am. 2009. V.301. P. 54–61.
- James K.D., Ellington A.D. Surprising fidelity of template-directed chemical ligation of oligonucleotides // Chem. Biol. 1997. V.4. №8. P.595–605.
- Powner M.W., Gerland B., Sutherland J.D. Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions // Nature. 2009. V.459. P.239–242.
- Doi:10.1038/nature08013.
- Butch C., Cope E.D., Pollet P. et al. Production of tartrates by cyanide-mediated dimerization of glyoxylate: a potential abiotic pathway to the citric acid cycle // J. Am. Chem. Soc. 2013. V.135. P.13440–13445.
- Doi:10.1021/ja405103r.
- Bokov K., Steinberg S.V. A hierarchical model for evolution of 23S ribosomal RNA // Nature. 2009. V.457. P.977–980.
- Doi:10.1038/nature07749.

