Биотехнология
По стопам Гутенберга: трехмерная биопечать органов
Природа. 2013. №10. С.3–12 (с изменениями)
Миронов В. А.
Биотехнология
По стопам Гутенберга: трехмерная биопечать органов
Решить проблему нехватки органов для трансплантации обещает недавно возникшая и бурно развивающаяся область биомедицинской науки — тканевая инженерия. С помощью технологии трехмерной биопечати можно будет создавать функциональные органы человека в неограниченном количестве. И эти надежды небеспочвенны.
 |
Очевидно, что биоинженерия человеческих органов требует новых технологических разработок. Одна из них — трехмерная биопечать органов (3D-bioprinting) — роботизированное послойное формирование трехмерных объектов по их компьютерным образам. В разработке этого метода современные «биопечатники» в какой-то степени идут по стопам великого Иоганна Гутенберга, создавшего европейский способ книгопечатания. Чтобы напечатать книгу, как известно, надо иметь текст, бумагу, чернила или краску, печатающий пресс или печатный станок и, наконец, литеру. Для биопечати органов необходимы трехмерная компьютерная модель органа, биобумага — специальный гидрогель, биочернила — способные сливаться между собой тканевые сфероиды, картридж для них и биопринтер — диспенсер, т.е. роботическое раздаточное устройство.
Три источника и три составных части
В современном мире все новые технологии создаются, как правило, на основе уже существующих, которые творчески (или креативно, как модно ныне говорить) комбинируют и приспосабливают для решения новых практических задач. Метод трехмерной биопечати органов — не исключение из этого общего правила. Он вобрал в себя достижения информационных и технических наук, науки о биоматериалах, а также биологии развития и клеточной биологии, которые стали, перефразируя название известной статьи, «источниками» и «составными частями» технологии 3D-bioprinting.
Термин «organ printing» предложила британская журналистка, комментируя работы Линды Гриффит (L. Griffith) и Майкла Симы (M. Cima) из Массачусетского технологического института в США. Американские ученые впервые использовали технологию быстрого прототипирования для изготовления из синтетических полимеров пористых скаффолдов(*)Скаффолд (от англ. scaffold — леса, подмостки) — временный (растворяющийся со временем) полимерный каркас, служащий основой для нанесения дифференцированных или стволовых клеток. — Примеч. ред.
Изначально технология быстрого прототипирования применялась для изготовления трехмерных компьютерных моделей (прототипов) различных деталей в автомобильной, авиационной, аэрокосмической и других отраслях промышленности. По сути, происходит создание физического объекта в строгом соответствии с математической моделью, построенной с помощью специальных компьютерных программ CAD (от англ. computer-aided design — автоматизированное проектирование). Теперь эта технология, которую сейчас принято называть аддитивным производством или технологией послойного синтеза, также стала главной составной частью трехмерной биопечати oрганов. Быстрое прототипирование призвано превратить виртуальную модель, созданную с использованием трехмерного клинического изображения органа, в реальный искусственный орган.
Вторая неотъемлемая часть биопечати органов — разнообразные биоматериалы, которые позволяют создавать желаемую геометрическую форму — каркас органа, удерживающий живые клетки в заданном положении в трехмерном пространстве. Без таких биологически совместимых и со временем разлагающихся биоматериалов (особенно гидрогелей, чувствительных к стимулам) невозможно дальнейшее совершенствование этой технологии. Например, успешное развитие лазерных методов биопечати немыслимо без новых фоточувствительных биоматериалов.
Третья важнейшая составляющая технологии 3D-bioprinting и ее отличительная особенность от других методов быстрого прототипирования — использование непо-средственно в процессе биопечати живых клеток или сконструированных из них тканевых сфероидов (микротканей). Их образование, слияние и ускоренное созревание напечатанного органа — это фундаментальные проблемы таких наук, как биология развития и клеточная биология.
Более того, практическая реализация технологии биопечати тесно связана с разработкой методов изоляции, селекции, деления (пролиферации), направленной клеточной и тканевой дифференцировки стволовых клеток человека, отвечающих клиническим и этическим требованиям. Но это отдельная и очень обширная тема, которая требует специального рассмотрения и выходит далеко за рамки статьи.
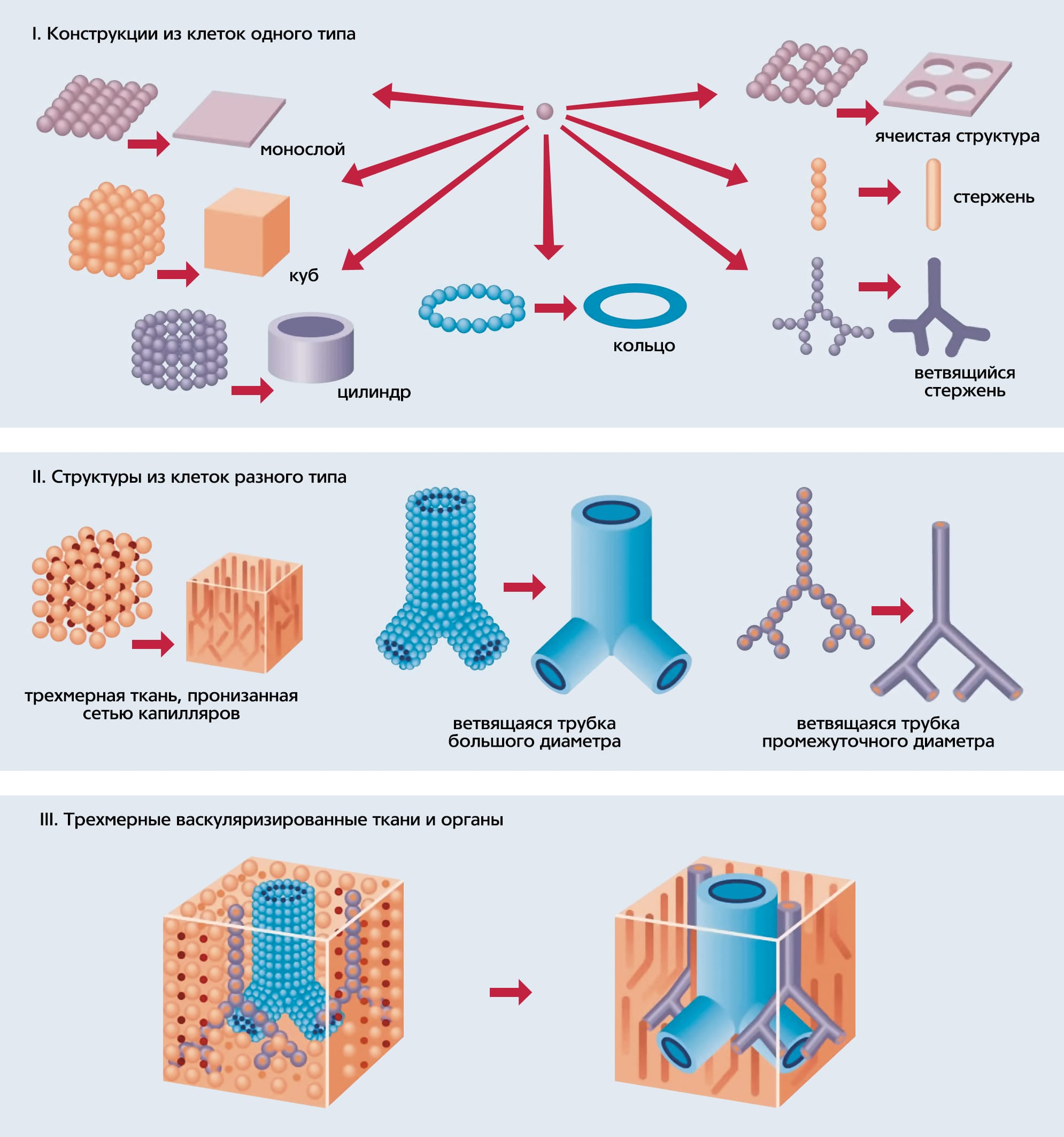
Поскольку в том варианте технологии 3D-bioprinting, который разрабатываем мы, в качестве строительных блоков используются тканевые сфероиды, чуть подробнее расскажу о том, как возникла эта идея. История началась на кафедре анатомии и клеточной биологии Медицинского университета штата Южной Каролины в Чарлстоне, где я в то время работал. Профессор кафедры Роберт Томпсон (R. P. Thompson), изучавший пролиферацию эмбриональных клеток сердца цыпленка, провел эксперимент: разрезал сердце на колечки, вывернул наизнанку и насадил близко друг к другу на полиэтиленовую трубку. Спустя несколько дней они полностью срослись и начали синхронно сокращаться, как прежде единое сердце. Увиденное меня не только удивило, но и навело на мысль — а что если расположить кусочки эмбриональной микроткани (а лучше стандартизированные тканевые сфероиды) так, чтобы они тесно соприкасались друг с другом и в горизонтальном, и в вертикальном положении. Удерживать их таким образом можно, например, заключив в последовательные слои гидрогеля, которые со временем должны деградировать. Если тканевые сфероиды сольются, то их можно будет использовать для изготовления живых трехмерных структур любой формы, т.е. для биопечати.
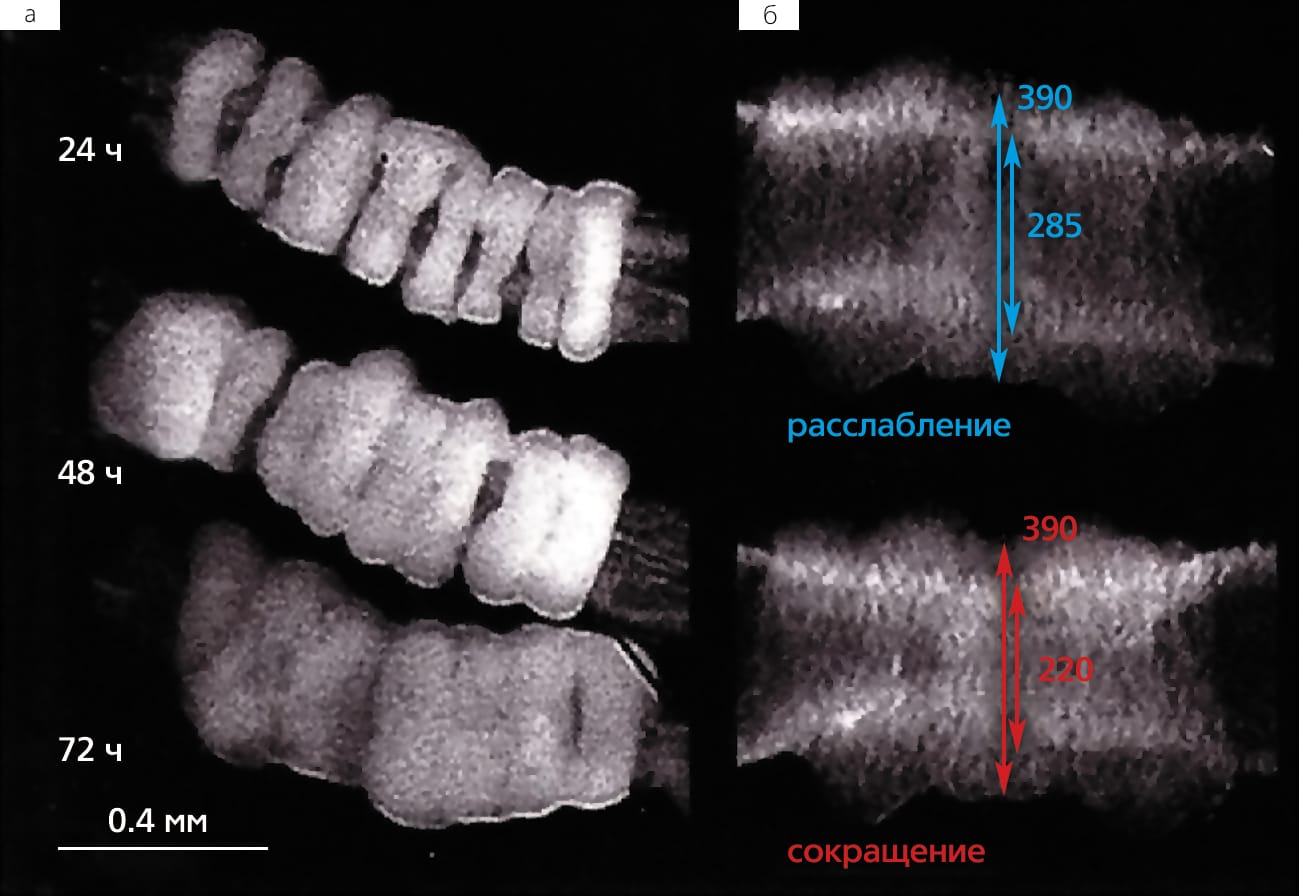
В 2003 г. мы опубликовали статью, в которой впервые сформулировали концепцию технологии 3D-bioprinting, описали ее биологические основы и технологическую осуществимость [2]Mironov V., Boland T., Trusk T. et al. Organ printing: computer-aided jet-based 3D tissue engineering // Trends Biotechnol. 2003. V.21. №4. P.157–161. Спустя десятилетие эта статья, по данным поисковой системы «Web of Science», по-прежнему активно цитируется. Упоминаются наши пионерные работы и в обзоре, автор которого, профессор Брайан Дерби из Университета Манчестера, пишет, что технология биопечати «открывает новые области для исследований в тканевой инженерии и регеренеративной медицине» [3]Derby B. Printing and prototyping of tissues and scaffolds // Science. 2012. V.338. №6109. P.921–926.
Печать в три этапа
На первой стадии биопечати (на этапе предварительной обработки, или pre-processing) необходимо создать трехмерную виртуальную модель органа на основании его клинического изображения, переведенного в CAD-формат. Затем эту модель надо виртуально разрезать на серийные срезы и трансформировать в специальный послойный формат — STL-file, легко распознаваемый и читаемый биопринтером. По сути, так создается детальная инструкция для биопринтера — что и в какой последовательности размещать в трехмерном пространстве. Создание компьютерной модели органа, читаемой роботом-биопринтером — задача нетривиальная. Дело в том, что собранная из тканевых сфероидов конструкция имеет тенденцию к сокращению (ретракции), приводящему к значительному уменьшению ее объема, поэтому при разработке компьютерной модели органа необходимо учитывать коэффициент ретракции, который определяется экспериментально.
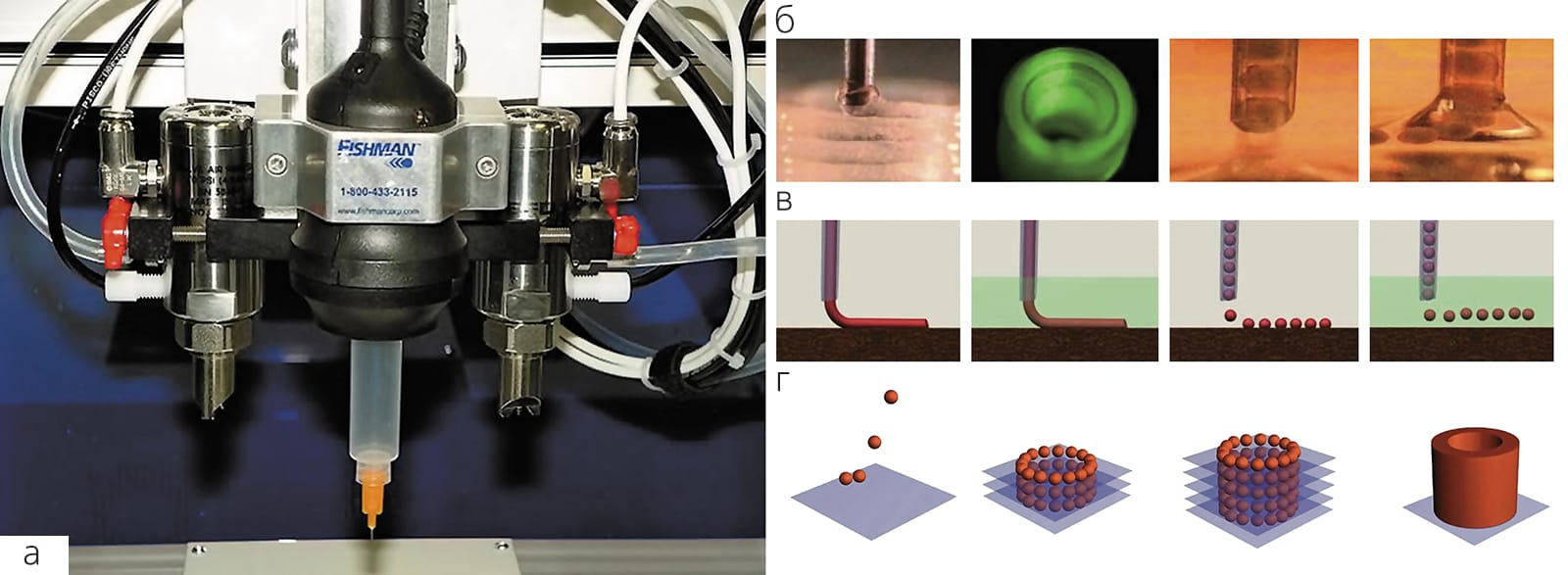
Второй этап — собственно печатание (processing), точнее, диспенсирование клеток и тканевых сфероидов с помощью роботического биопринтера, управляемого компьютером. «Биобумагой» служат разнообразные биосовместимые натуральные или синтетические гидрогели. Их можно либо диспенсировать вместе с клетками, либо распылять так, чтобы образовались последовательные слои гидрогеля, в которые встраивают тканевые сфероиды согласно заложенной компьютерной программе. Однако после окончания этого процесса напечатанная органная биоконструкция еще не готова к пересадке, она должна пройти дополнительную обработку (post-processing). На этом этапе должны полностью слиться сфероиды и сформироваться зрелые функциональные ткани будущего органа. Напечатанные внутри конструкции кровеносные сосуды должны срастись, стать функционально полноценными и достаточно прочными, чтобы выдержать ток (перфузию) крови или замещающих ее растворов и последующее хирургическое пришивание к сосудам реципиента. На все это требуется немало времени, однако чем дольше напечатанная конструкция будет находиться в биореакторе, тем дороже станет конечный продукт. Чтобы ускорить созревание тканей, можно использовать так называемые матурогены (от англ. maturation — созревание). Для поиска и оценки возможных кандидатов в матурогены мы разработали специальные методы тестирования in vitro [4]Hajdu Z., Mironov V., Mehesz A.N. et al. Tissue spheroid fusion-based in vitro screening assays for analysis of tissue maturation // J. Tissue Eng. Regen. Med. 2010. V.4. №8. P.659–664. С их помощью можно будет со временем создать коктейль из тщательно отобранных и протестированных факторов, который обеспечит максимально быстрое созревание свеженапечатанной биоконструкции и ее превращение в функционально полноценный человеческий орган, готовый для пересадки.
Кроме того, необходимо контролировать уровень функционального созревания органа, не повреждая его при этом. Следить за созревающим органом можно, непрерывно анализируя химический и биохимический состав циркулирующей жидкости, используемой в биореакторе, куда помещается напечатанная биоконструкция. Также можно использовать современные методы микроскопии, позволяющие послойно сканировать объект и получать трехмерные изображения высокого качества. Наконец, напечатанные органы должны помещаться в специально сконструированные биореакторы, обеспечивающие плавный переход по мере созревания тканей от межклеточного кровоснабжения (интерстициальной перфузии) к внутрисосудистому [5]Mironov V., Visconti R.P., Kasyanov V. et al. Organ printing: tissue spheroids as building blocks // Biomaterials. 2009. V.30. №12. P.2164–2174.
Естественно, сначала первый человеческий орган будет напечатан лишь виртуально, или in silico, т.е. с использованием современных методов математического и компьютерного моделирования. С моими бразильскими коллегами из отдела трехмерных технологий Центра информационных технологий имени Ренато Арчера мы уже начали разрабатывать компьютерные модели человеческих органов для биопечати. К тому же уже появились коммерческие биопринтеры, новые биоматериалы и методы масштабной автоматизированной биофабрикации тканевых сфероидов, т.е. технологическое обеспечение второго этапа биопечати. Это внушает вполне обоснованный оптимизм, однако, чтобы довести технологию до безопасного и успешного использования в клинике, необходимо решить еще немало биологических и технических задач, для чего потребуются максимальные совместные усилия ученых разных специальностей и инженеров. На наш взгляд, основные трудности нас ждут на последнем этапе — этапе ускоренного созревания напечатанных биоконструкций.
Ключевые проблемы
Выбор клеток, сохранение их жизнеспособности во время биопечати, взаимодействие с твердыми биоматериалами и гидрогелями, направленная дифференцировка и т.д. — безусловно, очень важные, но не ключевые биологические проблемы технологии 3D-bioprinting, без решения которых она просто не будет работать. Ее судьба зависит от трех принципиальных задач, которые стоят перед нами сегодня. Первая из них — разработка массового производства тканевых сфероидов стандартных размеров и сложной внутренней структуры. За последние пять лет разработаны несколько таких методов. Один из них — усовершенствованный (роботизированный) метод выращивания клеточных культур по типу «висячей капли», созданный выдающимся русским гистологом А. А. Максимовым. В других случаях для формирования тканевых сфероидов используют неадгезивные (т.е. не взаимодействующие с клетками) гидрогели. Специалисты по высокоскоростной капельной микрофлюидике(*)Микрофлюидика (от греч. μικρoζ — малый и лат. fluidis — текучий) — междисциплинарная наука, описывающая поведение малых (порядка микро- и нанолитра) объемов и потоков жидкости. — Примеч. ред. разработали метод для создания капелек гидрогеля (полимеросом), в которые инкапсулированы клетки. Такие структуры обладают биоразлагаемыми и биосовместимыми мембранами.
Вторая важнейшая задача — васкуляризация напечатанных биоконструкций. Ясно, что если не снабдить их кровеносной системой, они обречены на гибель. Настоящим прорывом в этом деле стали методы печати сосудистой системы с использованием водорастворимых, на основе сахаров, полимеров (их называют «sacrificial» — жертвенными). Так образуются микроканалы, которые впоследствии подвергаются перфузионной эндотелизации [6]Visconti R.P., Kasyanov V., Gentile C. et al. Towards organ printing: engineering an intra-organ branched vascular tree // Expert Opin. Biol. Ther. 2010. V.10. №3. P.409–420. Формирования сосудистого просвета можно также добиться за счет смерти клеток, временно заполняющих просвет сфероидов. Полагаю, что наиболее перспективно сразу использовать люменизированные (от англ. lumenal — просвет) сфероиды, которые при слиянии образуют полноценную сосудистую сеть. Однако не так важно, какие именно сфероиды (с просветом или без), в любом случае они позволят напечатать орган с уже встроенной ветвящейся сосудистой системой. И тому уже есть и теоретическое, и частично экспериментальное подтверждение [5]Mironov V., Visconti R.P., Kasyanov V. et al. Organ printing: tissue spheroids as building blocks // Biomaterials. 2009. V.30. №12. P.2164–2174.[6]Visconti R.P., Kasyanov V., Gentile C. et al. Towards organ printing: engineering an intra-organ branched vascular tree // Expert Opin. Biol. Ther. 2010. V.10. №3. P.409–420.
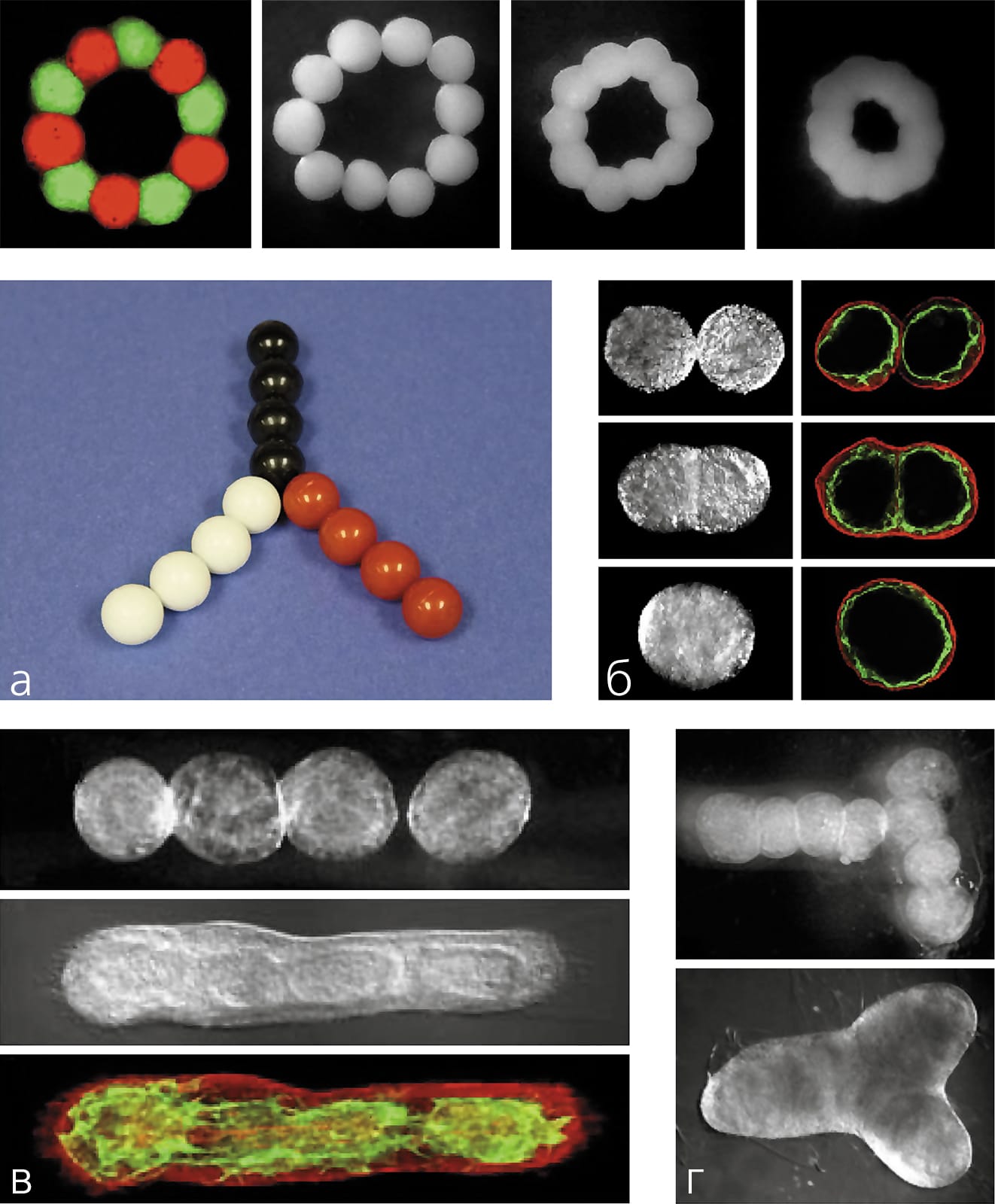
В решении третьей задачи — разработке эффективных и надежных методов быстрого тканевого созревания напечатанных тканей — пока достигнут не столь значительный прогресс, хотя и здесь уже есть очень интересные наработки. Например, три независимые группы исследователей показали, что сосуды, сделанные только из клеток (т.е. без использования каких-либо твердых поддерживающих каркасов, или скаффолдов), могут быстро созревать в биореакторе и приобретать свойства, сопоставимые со свойствами натуральных кровеносных сосудов [7]Marga F., Jakab K., Khatiwala C. et al. Toward engineering functional organ modules by additive manufacturing // Biofabrication. 2012. V.4. №2. P.1–12. Это означает, что клетки, если они изначально плотно прижаты друг к другу, довольно быстро начинают синтезировать достаточное количество структурных белков (коллагена и эластина), которые определяют механические свойства стенки сосудистой ткани. По сути, это прямо доказывает справедливость нашей концепции — печатать ткани можно без использования твердых скаффолдов. Но пока это лишь начало, хотя и весьма обнадеживающее.
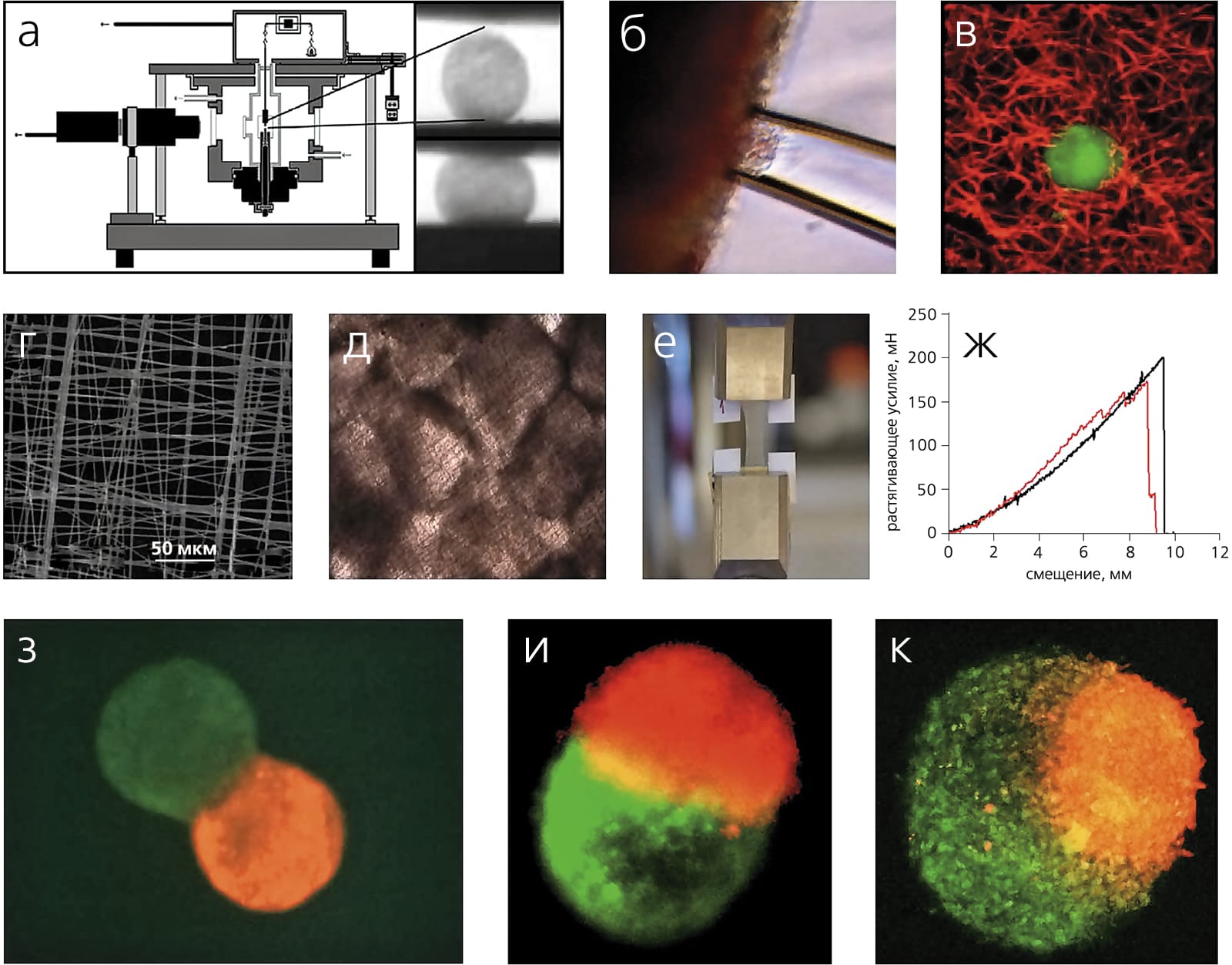
Кроме того, напомним, что в технологии биопечати заложена фундаментальная биологическая основа — феномен слияния тканей. Интересно, что впервые этот феномен был обнаружен и экспериментально продемонстрирован почти 100 лет назад. В 1907 г. морской биолог Гентри ван Петерс Вилсон описал слияние и регенерацию морских губок, предварительно измельченных путем продавливания сквозь сито (*)Подробнее см.: Лавров А. И., Косевич И. А. Реагрегация клеток у губок // Природа. 2013. №2. С. 87–90. — Примеч. ред. Наверняка этот ученый не мог себе даже на минуту представить, что его наблюдения приведут к последующему систематическому изучению клеточных и молекулярных механизмов клеточной адгезии и тканевой ассоциации и, таким образом, заложат биологическую основу технологии печатания органов.
В последнее время много внимания уделяется изучению клеточного цитоскелета (*)Подробнее см.: Алиева И. Б., Узбеков Р. Э. Цитоскелет — современный взгляд на архитектуру клетки // Природа. 2012. №10. С.16–23. — Примеч. ред. Например, установлено, что разрушение его актиновых компонентов не только мешает сборке клеточных суспензий, но и препятствует слиянию уже с форми ровавшихся тканевых сфероидов. В связи с этим разрабатываются методы, позволяющие оценивать свойства тканевых сфероидов в пассивном и активном состоянии [8]Gonzalez-Rodriguez D., Guevorkian K., Douezan S. et al. Soft matter models of developing tissues and tumors // Science. 2012. V.338. №6109. P.910–917. В каких-то ситуациях их эффективному слиянию может препятствовать гидрогель, в который они заключены [9]Jakab K., Neagu A., Mironov V. et al. Engineering biological structures of prescribed shape using self-assembling multicellular systems // Proc. Natl. Acad. Sci. USA. 2004. V.101. №9. P.2864–2869. Подбор идеального гидрогеля — еще одна сложная задача.
От биопринтера к конвееру
Биопринтер, как и печатный станок Гутенберга, — ключевой элемент печати, только не книг, а органов. Хотя существует несколько вариантов технологии 3D-bioprinting, требования к биопринтерам в основном общие. Любой из них должен быть оснащен роботом (точной позиционной трехмерной аксиальной системой), который управляет соплом, или автоматизированным шприцем. Перемещаясь в трех измерениях, он выделяет суспензию клеток с гидрогелем или отдельные тканевые сфероиды. За роботом следит автоматическое контрольное устройство с компьютером, чтобы виртуальная модель стала реальной структурой. Помимо дисперсионных биопринтеров существуют также их специализированные формы, основанные на лазерной и струйной технологиях [3]Derby B. Printing and prototyping of tissues and scaffolds // Science. 2012. V.338. №6109. P.921–926. Более того, уже есть новые экспериментальные модели, которые используют ударную акустическую волну и не имеют сопла как такового.
Долгое время наивно полагали, что для создания органов достаточно лишь одного биопринтера, но это не так. Речь уже идет об автоматизированной линии роботов, отчасти напоминающей конвейеры по производству автомобилей или линии сборки микропроцессоров в электронной промышленности. Линия производства человеческих органов будет включать специальные системы (сортеры) для выделения клеток, роботы по производству тканевых микросфероидов, собственно биопринтеры и перфузионные биореакторы. В Бразилии мы разрабатываем виртуальный прототип будущего завода по изготовлению человеческих органов в промышленном масштабе. Виртуальное производство уже широко используется в качестве инструмента для планирования, разработки и анализа технологий, а также для тренировки и обучения персонала в современной авиационно-космической, автомобильной и нефтяной промышлености. Виртуальная линия по производству человеческих органов будет выполнять аналогичные задачи. Базовые компьютерные программы, позволяющие создавать такую виртуальную линию, уже разработаны — дело лишь за их применением для конкретной задачи.
Настоящее и будущее биопечати
С помощью технологии 3D-bioprinting уже созданы фрагменты кожи и хряща, наружное ухо и спинной диск, сегменты сосудистого дерева и печени. Крупные фармакологические компании проявляют большой интерес к ним: напечатанные функциональные микротканевые структуры могут быть использованы для моделирования человеческих болезней in vitro и для токсикологических исследований, например для тестирования новых лекарственных препаратов. Несколько крупных компаний взялись за производство коммерческих биопринтеров, и уже созданы их экспериментальные модели. Похоже, «дорожная карта» технологии трехмерной биопечати органов, предложенная нами десятилетие назад, успешно реализуется. По каким же направлениям ей предстоит развиваться в ближайшие годы?
В последнее время становятся очень популярны так называемые гибридные технологии, когда комбинируются несколько уже известных подходов: например, одновременное печатание твердого полимера и гидрогеля со смешанными с ним живыми клетками или сочетание распыления твердого полимера методом электроспиннирования(*)Электроспиннирование (от англ. spinning — прядение) — «электропрядение», технология получения нановолокон в электрическом поле. — Примеч. ред. со струйной печатью живых клеток. Вместе с бразильскими учеными мы разработали технологию встраивания тканевых сфероидов в твердые микроскаффолды, способные к самосборке, которые назвали «lockyballs» (от англ. lock — блокировка и ball — мяч). Это своего рода «авоська» для сфероида, сделанная с помощью стереолитографии. На поверхности этой ажурной сферической конструкции есть подобные шипам репейника отростки, скрепляющие микроскаффолды друг с другом, причем мгновенно и очень прочно, что недостижимо с помощью существующих гидрогелей, для полимеризации которых требуются время и токсичные фотоактиваторы. Однако наша разработка не отменяет поиск новых биосовместимых гидрогелей и других биоматериалов. Несомненно, будут продолжены исследования и по всем другим направлениям и описанным ключевым биологическим проблемам технологии 3D-bioprinting. Пожалуй, самое перспективное направление, которое уже начали разрабатывать в нескольких странах, — это так называемая биопечать in situ, т.е. печать тканей непосредственно на больном в операционной. Это начавшееся сближение роботической хирургии с биопечатью может дать самые интересные результаты и проложит дорогу технологии 3D-bioprinting в клинику.
Создание в России мультидисциплинарного национального центра биофабрикации и трехмерной биопечати тканей и органов стало бы чрезвычайно важным шагом для развития регенеративной медицины. Это гарантировало бы существенный и достойный вклад нынешнего поколения российских ученых и биоинженеров в развитие этого перспективного направления биомедицинской науки и технологии.
В 2012 году в Москве создана компания «3D Bioprinting Solutions», которая в феврале 2013 года получила статус организации, ассоциированной с инновационным центром «Сколково». Еще через полгода открылась первая частная лаборатория биотехнологических исследований. Научная группа, в которой собраны ведущие специалисты в области регенеративной медицины, под руководством С. В. Новоселова разрабатывают методы трехмерной биопечати для получения универсальных тканевых конструкций из аутологичных стволовых клеток пациента.
Работа выполнена при поддержке Фонда содействия исследованиям в штате Сан-Паулу (Foundation for Research Support of the State of San Paulo) и Бразильского совета по развитию науки и технологии (National Council for Scientific and Technological Development).
В Сколково прошел традиционный Startup Village. Юлия Смирнова и Юсеф Хесуани показали премьеру первый отечественный 3D-биопринтер и первый в мире напечатанный целый органный конструкт мыши.
Сотрудники лаборатории биотехнологических исследований «3D Bioprinting Solutions».

«Экскурсия по лаборатории «3D Bioprinting Solutions»
В июле 2014 г. в лаборатории «3D Bioprinting Solutions» был собран первый отечественный трехмерный биопринтер FABION.
Мультифункциональный трехмерный биопринтер «Фабион». Три его форсунки предназначены для «биочернил» (тканевых сфероидов или суспензии различных клеток), две другие — для «биобумаги» (биодеградиремых гидрогелей, которые не только фиксируют сфероиды в нужном положении, но и служат питательной средой для клеток).
27 марта 2015 г. с помощью биопринтер FABION была напечатана первая органная конструкция, предназначенная для создания искусственной щитовидной железы.
Напечатанный на 3D-биопринтере органный конструкт щитовидной железы успешно имплантирован мыши.
4 августа 2016 г. Объединенная ракетно-космическая корпорация, которая входит в Госкорпорацию «РОСКОСМОС», подписала соглашение с компанией «3D Bioprinting Solutions», резидентом инновационного центра «Сколково», о сотрудничестве, в рамках которого планируется создать уникальный биопринтер для магнитной биофабрикации тканей и органных конструктов в условиях невесомости на Международной космической станции.
Создание магнитного биопринтера позволит печатать в космосе тканевые и органные конструкты, сверхчувствительные к воздействию космической радиации – сентинел-органы (например, щитовидную железу) для биомониторинга отрицательного действия космической радиации в условиях длительного пребывания в космосе и разработки профилактических контрмер.
В перспективе технология трехмерной магнитной биопечати может быть использована для коррекции повреждений тканей и органов космонавтов при длительных космических полетах. На Земле такая технология может быть применена для более быстрой биопечати человеческих тканей и органов.
Планируется, что биопринтер для отправки на борт Международной космической станции будет готов к 2018 г. Все работы по подготовке и проведению эксперимента будут проводиться в сотрудничестве с ПАО «РКК «Энергия» и Институтутом медико-биологических проблем РАН.
Литература
- Langer R., Vacanti J.P. Tissue engineering // Science. 1993. V.260. №5110. P.920–926.
- Mironov V., Boland T., Trusk T. et al. Organ printing: computer-aided jet-based 3D tissue engineering // Trends Biotechnol. 2003. V.21. №4. P.157–161.
- Derby B. Printing and prototyping of tissues and scaffolds // Science. 2012. V.338. №6109. P.921–926.
- Hajdu Z., Mironov V., Mehesz A.N. et al. Tissue spheroid fusion-based in vitro screening assays for analysis of tissue maturation // J. Tissue Eng. Regen. Med. 2010. V.4. №8. P.659–664.
- Mironov V., Visconti R.P., Kasyanov V. et al. Organ printing: tissue spheroids as building blocks // Biomaterials. 2009. V.30. №12. P.2164–2174.
- Visconti R.P., Kasyanov V., Gentile C. et al. Towards organ printing: engineering an intra-organ branched vascular tree // Expert Opin. Biol. Ther. 2010. V.10. №3. P.409–420.
- Marga F., Jakab K., Khatiwala C. et al. Toward engineering functional organ modules by additive manufacturing // Biofabrication. 2012. V.4. №2. P.1–12.
- Gonzalez-Rodriguez D., Guevorkian K., Douezan S. et al. Soft matter models of developing tissues and tumors // Science. 2012. V.338. №6109. P.910–917.
- Jakab K., Neagu A., Mironov V. et al. Engineering biological structures of prescribed shape using self-assembling multicellular systems // Proc. Natl. Acad. Sci. USA. 2004. V.101. №9. P.2864–2869.